Der Name Nattokinase (NK) ist biochemisch etwas irreführend, denn ein Enzym, welches als „Kinase“ definiert wird, katalysiert eigentlich die Phosphorylierung von Proteinen. Die Nattokinase ist aber funktionell eine „Proteinase“. Das bedeutet, es ist ein Enzym, das Proteine abbauen kann.
„Natto“ ist eine traditionelle Speise in Japan (mehr als 2000 Jahre alt), die durch die Fermentation von Sojabohnen mit Bacillus subtilis bereitet wird. Diese Speise enthält die Nattokinase, ein extrazelluäres Enzym, das aus dem Bacillus subtilis stammt. Regelmäßige Konsumation von „Natto“ senkt das Risiko von Herzerkrankungen, vor allem koronarer Erkrankungen (siehe Literatur). Schon 1987 wurde die Nattokinase als aktive Substanz identifiziert.
1. Anwendung als Antikoagulans
Die Nattokinase* hat potente fibrinolytische und antikoagulierende Aktivität, die in Studien sowohl im Menschen als auch im Tier gezeigt wurde. Nattokinase kann oral verabreicht werden ohne bekannte Nebenwirkungen. Die thrombolytische Aktivität von Nattokinase, nämlich einen Thrombus aufzulösen, ist stärker als die des Plasmins. In einem Rattenexperiment konnte gezeigt werden, dass durch orale Gabe von Nattokinase die Anzahl pulmonaler Thromben signifikant reduziert werden kann. Außerdem wurde ein Anstieg des tPA (tissue Plasminogen Activator) Spiegels im Blut nachgewiesen, was auf eine Aktivierung der Fibrinolyse hindeutet. Die Nattokinase spaltet das Protein PAI-1 (Plasminogen Activator Inhibitor) in kleine Fragmente und aktiviert dadurch tPA. Auch andere fibrinolytische Enzyme, wie die Urokinase, werden aktiviert.
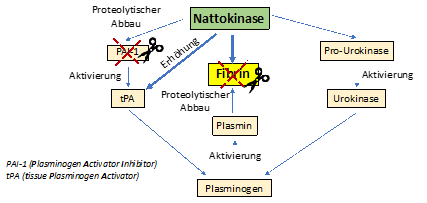
Weiters kann die Nattokinase die Bildung von Thromboxanen (Substanzen, die ähnlich den Prostaglandinen sind) blockieren, wodurch die Aggregation der Blutblättchen verhindert wird, ohne dass dabei Blutungen entstehen. Es gibt Hinweise, dass sich die Gabe von Nattokinase bremsend auf die Bildung von atherosklerotischen Plaques auswirkt. (Siehe Literatur) Thrombolytische Therapie wird bei einigen Erkrankungen eingesetzt, wobei häufig Plasminogen Aktivatoren, Streptokinase, tPA (z.B. Actilyse) und einiges mehr angewendet werden. Nachteile dieser Medikamente können unerwünschte Nebenwirkungen, wie unkontrollierbare Blutungen, sein. Meist sind diese Medikamente auch teuer, da Biotherapeutika wie diese langen Entwicklungszeiten in Präklinik und Klinik benötigen. Zusätzlich haben die Substanzen nach der intravenösen Applikation eine geringe Halbwertszeit im Blut.
Thrombolytische Medikation ist häufig auch nach einer SARS-CoV-2 mRNA Spritze notwendig, da vermehrt Thrombosen entstehen können. Hierfür bietet sich die Nattokinase als eine mögliche Therapie an.
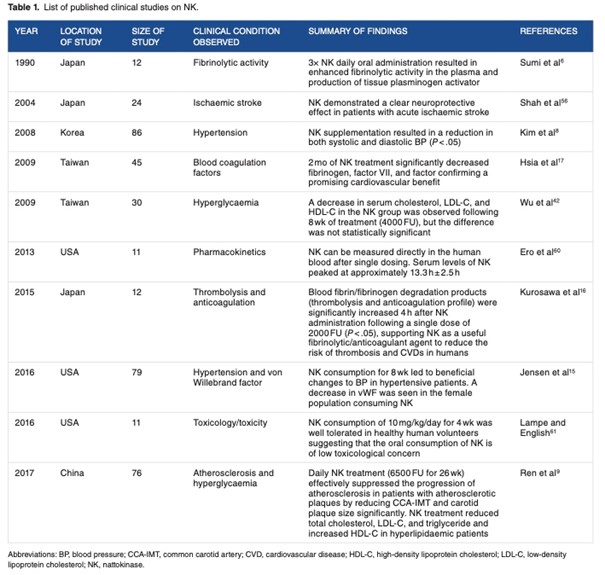
Nachfolgend eine Liste einiger publizierten klinischen Studien zur Nattokinase
2. Abbau des SARS-CoV-2 Spikeproteins durch Nattokinase
Um zu verstehen, wie die Nattokinase SARS-CoV-2 blockieren kann, muss man kurz die SARS-CoV-2 Biologie beleuchten. Das Virus kann mit Hilfe des Spikeproteins (SP) in die Zelle eindringen. Das Spikeprotein ist in die Virushülle integriert und steht von der Virusoberfläche ab. Durch eine spezifische Protease TMPRSS2 (transmembrane protease serine subtype2) auf der Membran der Zielzelle, wird das Spikeprotein gespalten und damit aktiviert. Die Spaltung erfolgt zwischen der S1 und S2 Domäne, wobei die S1 Domäne an die ACE2 Rezeptoren (Angiotensin Converting Enzyme) der Zielzelle des Virus bindet. Die S2 Domäne ist an der Fusion des Virus mit der Zellmembran beteiligt.
Um den degenerativen Effekt der Nattokinase auf das Spikeprotein zu untersuchen, wurde das Spikeprotein im Reagenzglas in Zellen produziert. Anschließend wurden die Zellen lysiert und dieses Lysat (mit dem Spikeprotein) wurde dann mit verschiedenen Konzentrationen eines Nattokinase Extrakts über mehrere Stunden inkubiert. Das Vorhandensein von intaktem Spikeprotein im Lysat wurde dann zu verschiedenen aufeinanderfolgenden Zeitpunkten untersucht. Dabei stellte sich heraus, dass der Abbau des Spikeproteins sowohl von der Konzentration der Nattokinase als auch von der Dauer der Inkubation abhängig war. Die Inkubation des Lysates mit Nattokinase (Konzentration 1µg/ml) über zwei Stunden war ausreichend, um das Spikeprotein vollständig abzubauen, denn es konnte kein Spikeprotein mehr im Lysat nachgewiesen werden. Blockiert man die enzymatische (proteolytische**) Aktivität der Nattokinase, z.B. durch Erhitzen der Nattokinase auf 100°C (dadurch wird die NK denaturiert/inaktiviert), dann bleibt das Spikeprotein vollständig intakt. Das zeigt, dass in diesem Versuch die Nattokinase für den Abbau des Spikeproteins verantwortlich ist.
Als nächstes wurde untersucht, ob die Nattokinase das Spikeprotein auch abbauen kann, wenn sich das Spikeprotein an der Zelloberfläche von intakten Zellen befindet. Dafür wurde, wie bereits beschrieben, das Spikeprotein wieder im Reagenzglas in die Zellen eingebracht. Anschließend wurden die Zellen mit Nattokinase Extrakt inkubiert, und schließlich wurde das Spikeprotein mit einem spezifischen Antikörper auf den Zellen (rot) nachgewiesen. Gleichzeitig wurde auch die Viabilität der Zellen gemessen, um herauszufinden, ob der Abbau des Spikeproteins durch die Nattokinase auch zum Tod der Zellen führt (Färbung der intakten Kerne in blau). Die Ergebnisse weisen darauf hin, dass die Nattokinase das SARS-CoV-2 Spikeprotein an der Zelloberfläche abbauen kann, ohne dabei die Zellen zu schädigen.
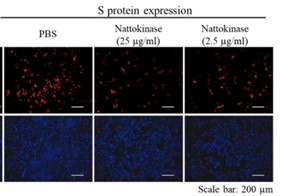
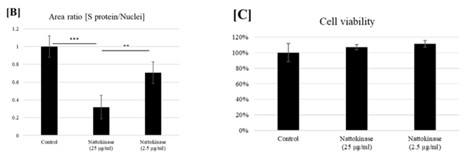
Natürlich darf man bei diesen Ergebnissen nicht vergessen, dass es sich um in vitro Experimente handelt. Aber die Resultate könnten einen Weg weisen, wie zelluläres Spikeprotein (d.h. SP an der Zelloberfläche) abgebaut werden kann.
Dr. Renate Konopitzky
*Die Nattokinase besteht aus 275 Aminosäuren und gehört zu der Gruppe der Serin Proteasen mit einer konservierten Aminosäurensequenz Ser-His-Asp (Asparagin an Position 32, Histidin an Position 64 und Serin an Position 221), die bei den Serin Proteasen zu finden ist.
**Proteolyse – Abbau von Proteinen
Literatur
- Biomarker Insights 2018, Volume 13: 1–8; Sagepub.co.uk; DOI: 01.117772/17179712871798158173805130
- Molecules 2022, 27, 5405. https://doi.org/10.3390/molecules27175405
- Biochemical and Biophysical Research Communications 570 (2021) 21-25
![]()
